Սովորել ՝ Թթվային օքսիդներ։ Թթուներ։
Թթուներ: Հիմքեր: Աղեր
Բոլոր լուծելի թթուները, հիմքերը և աղերը էլեկտրոլիտներ են: Ջրում լուծելիս դրանք դիսոցվում են դրական և բացասական իոնների.
Ի՞նչն է ընդհանուրը միացությունների նույն դասին պատկանող էլեկտրոլիտների դիսոցման գործընթացում:
Նախորդ բաժիններից դու արդեն գիտես. քլորաջրածին գազը ջրում լուծելիս դիպոլ-դիպոլային փոխազդեցության հետևանքով այն դիսոցվում է՝ ըստ հետևյալ հավասարման. HCl→H++Cl−, առաջացնելով ջրածնի կատիոն և քլորիդ անիոն:
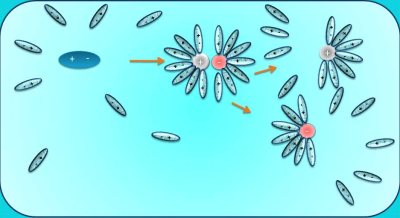
Նույն կերպ են դիսոցվում նաև մյուս թթուները, օրինակ. HNO3→H++NO−3, հետևաբար.
Թթուներն այն էլեկտրոլիտներն են, որոնց դիսոցումից ստացվում են ջրածնի կատիոններ ու թթվային մնացորդի անիոններ:
Ջրային լուծույթներում թթուների բոլոր ընդհանուր հատկությունները պայմանավորված են ջրածնի հիդրատացված կատիոնների առկայությամբ:
Ջրածնի կատիոնները թթուների ջրային լուծույթներում հիդրատացվում են, վերածվելով հիդրօքսոնիում իոնների. H++H2O→H3O+
Հետևաբար թթուների դիսոցման հավասարումները ավելի ճշգրիտ ձևով ներկայացվում են ջրի մոլեկուլների մասնակցությամբ. օրինակ՝
HCl+H2O⇄H3O++Cl−, կամ HNO3+H2O→H3O++NO−3
Ըստ դիսոցման ժամանակ առաջացած ջրածնի կատիոնների թվի՝ թթուները լինում են.
միահիմն՝ HJ,HNO2,HClO4,HClO,CH3COOH և այլն,
երկհիմն՝ H2SO4,H2SO3,H2CO3,H2SeO3,H3PO3 և այլն,
եռահիմն՝ H3PO4,H3AsO4 և այլն,
քառահիմն՝ H4P2O7 և այլն:
Որոշ դեպքերում թթվի մոլեկուլում առկա ջրածնի ատոմների թիվը չի համընկնում թթվի հիմնայնության հետ. օրինակ CH3COOH-ը միահիմն թթու է, թեև նրա մոլեկուլում ջրածնի չորս ատոմներ կան, իսկ H3PO3-ը երկհիմն թթու է:
Բազմահիմն թթուները դիսոցվում են աստիճանաբար, օրինակ.
H2SO3⇄H++HSO−3HSO−3⇄H++SO2−3
Ընդ որում առաջին փուլի դիսոցումն ընթանում է ավելի մեծ չափով:
Նույն տարրի առաջացրած թթվածնավոր թթուներից առավել ուժեղ էլեկտրոլիտ է տարրի առավել մեծ օքսիդացման աստիճանին համապատասխանող թթուն:
Օրինակ՝ ծծմբական թթուն ուժեղ թթու է, իսկ ծծմբայինը՝ թույլ:
Համեմատելով հիմքերի դիսոցման հավասարումները՝
NaOH→Na++OH−,NH4OH⇄NH+4+OH−, կարելի է եզրակացնել.
Հիմքերն այն էլեկտրոլիտներն են, որոնց դիսոցումից առաջանում են մետաղի (ամոնիումի) կատիոններ և հիդրօքսիդ՝ OH− անիոններ:
Ջրային լուծույթներում հիմքերի բոլոր ընդհանուր հատկությունները պայմանավորված են հիդրօքսիդ անիոնների առկայությամբ:
Օքսիդացման +2 (և ավելի) աստիճան դրսևորող մետաղների հիդրօքսիդները՝ բազմաթթու հիմքերը դիսոցվում են աստիճանաբար:
Օրինակ՝
Ba(OH)→BaOH++OH−2I փուլ
BaOH+⇄Ba2++OH−II փուլ
ընդ որում առաջին փուլի դիսոցումն ընթանում է ավելի մեծ չափով:
Տարբեր աղերի դիսոցման հավասարումները համեմատելով՝
Na2CO3→2Na++CO2−3AlCl3→Al3++3Cl−NH4NO3→NH+4+NO−3
կարող ենք եզրակացնել.
Աղերն էլեկտրոլիտներ են, որոնք դիսոցվելիս առաջացնում են մետաղի (ամոնիումի) կատիոններ և թթվային մնացորդի անիոններ:
Ի տարբերություն բազմահիմն թթուների և բազմաթթու հիմքերի, աղերը դիսոցվում են անմիջապես ու լրիվ, այդ էլեկտրոլիտներն ատիճանաբար չեն դիսոցվում:
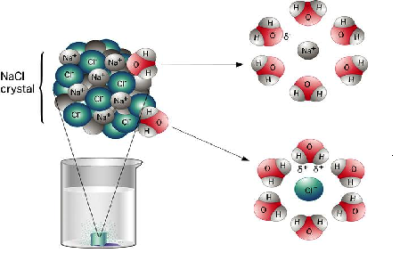
Աղերն ընդհանուր հատկություններ չունեն. աղերի հատկությունները պայամանավորված են և՛ կատիոններով, և՛ անիոններով:
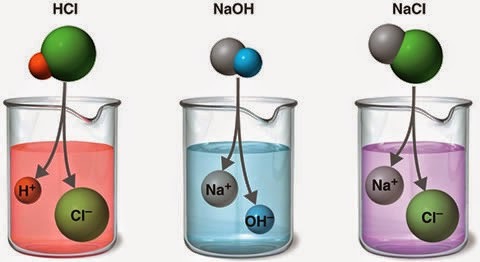
Թթուների, հիմքերի և աղերի անգույն լուծույթները միմյանցից կարելի է տարբերել թթվահիմնային հայտանյութերի միջոցով:
Օրինակ՝ լակմուսը թթուների ջրային լուծույթում ձեռք է բերում կարմիր գույն, հիմքերում՝ կապույտ, իսկ չհիդրոլիզվող աղերի ջրային լուծույթում պահպանում է իր գույնը՝ մանուշակագույնը.
Վարժություններ
1)Առաջին սյունակում տրված ռեակցիաների հավասարումների ձախ մասին համապատասխան երկրորդ սյունակից ընտրե՛ք աջ մասը.
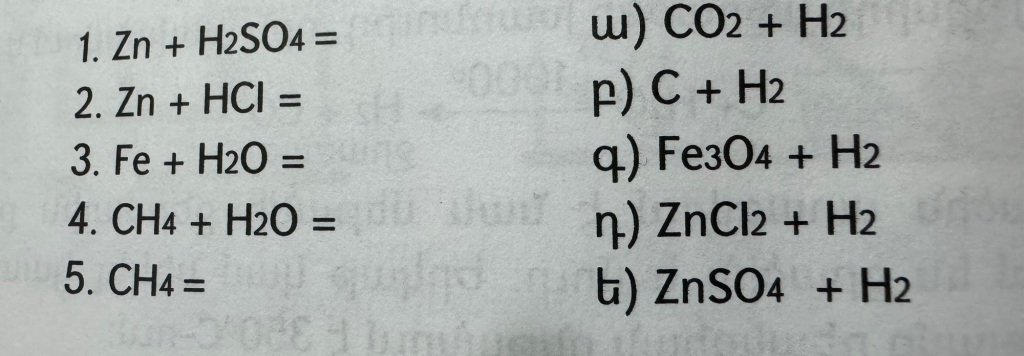
2)Լրացրու՛ բաց թողնված բառը թթուների, հիմքերի և աղերի էլեկտրոլիտային դիսոցման վերաբերյալ` հետևյալ նախադասությունում.
Աղերը դիսոցվում են անմիջապես և լրիվ:
Պատասխան՝ դիսոցվում
3)Ըստ քիմիական հատկությունների, ո՞ր տիպի օքսիդներին է պատկանում BeO:
- հիմնային
- թթվային
- երկդիմի
4)Տրված է նյութ՝ նատրիումի օքսիդ:
Կազմի՛ր քիմիական բանաձևը
Հաշվի՛ր տրված նյութի մոլային զանգվածը
Բանաձև՝
Մոլային զանգված՝ ….գ/մոլ
5)Որքա՞ն է թթվածնի զանգվածային բաժինը (%) ծծմբային թթվի մոլեկուլում:
(պատասխանը ներկայացրու տասնորդական թվի ճշտությամբ)
Պատասխան՝ …%
6)Որքա՞ն է թթվածնի զանգվածային բաժինը (%) ծծմբային թթվի մոլեկուլում:
(պատասխանը ներկայացրու տասնորդական թվի ճշտությամբ)
Պատասխան՝ …%